
PKH26紅色熒光細胞鏈接試劑盒
PKH26紅色熒光細胞鏈接試劑盒
PKH26 Red Fluorescent Cell Linker Kit
PKH26熒光細胞連接試劑盒采用擁有專利的膜標記技術,專利膜標記技術,穩定的與細胞膜脂質區結合并發出紅色熒光,染色方式依賴于細胞與膜的類型,主要用于細胞體外標記、體外細胞增殖研究及體內外細胞示示蹤研究。
| PKH26染料*1×10-3M (溶于乙醇) | 稀釋液C |
| 1×0.1mL | 1×10mL |
| 1×0.5mL | 60mL |
| 1mL | 120mL |
注意事項和免責說明
該產品僅用于科研,不用于制藥、家庭或其它用途。請遵照安全數據清單中關于有害及安全操作規范操作。
儲存/穩定性
PKH26乙醇溶液冷藏保存。保證染料乙醇溶液瓶蓋蓋緊減少蒸發以防止染料濃度升高。該染料避光保存,使用前觀察是否有結晶。如出現結晶,室溫防止30min,然后超聲或震蕩直至溶解。
稀釋液C可室溫或冷藏保存。如果冷藏保存,使用前復溫至室溫。稀釋液C為無菌溶液,不含任何防腐劑和抗生素,其需保持無菌。不要將染料儲存于稀釋液C中。溶于稀釋液C的工作液需現配現用,且配好后需立即使用。
一般細胞膜標記操作過程
親脂性染料結合到細胞膜上完成標記。染色強度是染料濃度和細胞濃度的函數,與滲透性無關。因此,保證染料添加量不過量非常關鍵。過標記的細胞將會導致細胞膜完整性缺失或降低細胞活性。
下列過程可用于體內體外細胞的標記,包括干細胞、淋巴細胞、單核細胞、內皮細胞、神經細胞或者任何其他細胞。體內細胞的標記過程需一定的改進,如血小板的染色,或者選擇性標記吞噬細胞。
下述染色過程中細胞濃度和染料濃度代表操作的起始濃度。該濃度被證明適用于多種細胞。使用者需通過評估染色后細胞活率(如,PI染色)、熒光強度、染色均勻度及是否對所研究細胞功能有影響等,根據實驗目的,確定最優的染料濃度和細胞濃度。
注意1:PKH26染色過程中,不能存在疊氮化物或代謝毒性物。
注意2:雖然貼壁細胞也可以染色,但單個懸浮細胞染色均一性更佳。因此用蛋白酶(trypsin/EDTA)將貼壁細胞消化成單個懸浮細胞后再染色效果更佳。
下列過程最終體積為2mL,PKH26濃度為2×10-6M,細胞濃度為1×107cells/mL。
以下過程均在室溫下進行(20-25℃)
1. 將2×107個細胞于離心管中,用不含血清培養基洗一遍。
注意:血清蛋白和脂質會與染料結合,降低與細胞膜結合的染料濃度。最好在用稀釋液C重懸細胞染色前(第四步)用無血清培養基或緩沖液洗細胞一次(第一步)。
2. 400×g離心5分鐘。
注意:PKH26染料不能直接加到離心沉淀中,這樣會造成細胞染色不均一和細胞活力降低。
3. 離心后,小心吸棄上層清液,剩余上層細 胞液體積不超過25μL。
注意:為得到可重復的實驗結果,在用稀釋液C重懸時,減少殘留培養基或緩沖液體積非常重要。見參考文獻9的注意28。
4. 加入1mL稀釋液C用移液管輕輕吹打混勻,制備 2×細胞懸液。不要用振蕩器震蕩,不要讓 細胞在稀釋液C中保存太長時間。
注意:生理鹽(physiologic salts)的存在會使得染料結團并大幅降低染色效率。因此,需確保染色時細胞懸浮于稀釋液C中,不含培養基或緩沖鹽。
5. 臨染色之前,將4μL PKH26乙醇溶液加 入1mL稀釋液C中,充分混勻,配制的 2×染色液(4×10-6M)。
注意1:為減少乙醇對細胞活率的影響,步驟5加入的染料使得步驟6中乙醇最終濃度不能超過1-2%。
注意2:如果所需染料最終濃度<2×10-6M,需用100%乙醇將PKH26稀釋于另一單獨的容器中,以確保實驗結果的可重復性。
6. 快速將1mL 2×細胞懸液(步驟4)加入 1mL 2×染色液(步驟5)中,立即用移液 管混勻。最終細胞濃度為1×107/mL,
PKH26濃度為2×10-6M。
注意:由于染色瞬間完成,快速將細胞與染料混勻對得到明亮、均勻和可重復的標記結果非常重要。下列措施有助于得到較優的結果:
a.不要將PKH26染料直接加入含2×細胞的稀釋液C中。
b. 將2×細胞懸液(步驟4)與2×染色液(步驟5)等體積混合。
c. 調整2×細胞和2×染料的濃度避免染色 體積太小(<100μL)或太大(>5mL)。
d. 用電動移液器快速將細胞和染料混勻。 血清移液管混勻速度太慢而使得染色不 均勻。Racking和旋渦震蕩混勻同樣混勻 較慢,染色均一性較差。
e. 分配體積盡量準確,以保證樣品與樣品 之間,實驗與實驗之間的可重復性。
7. 混勻后的染色的細胞孵育1-5 min。由于 染色速度較快,延長孵育時間對實驗沒有幫助。
注意:讓細胞在染色液中停留盡量短的時間,同時保證得到理想的染色強度。因為稀釋液C缺少生理性鹽,過長時間的暴露在稀釋液C中會造成某些細胞活力降低。如果不能確定其影響程度,可增加僅作稀釋的對照組和只用乙醇而不用染料染色的對照組。
8. 加入等體積的血清(2mL)或其它合適的蛋白溶液(如1% BSA)終止反應,孵育1min以結合多余的染料。
注意1:血清(或等效的蛋白濃度)為最優的終止液。如果用完全培養基替代,添加體積為10mL。
注意2:不要通過加稀釋液C或離心來終止反應。
注意3:不要用無血清培養基或緩沖鹽,他們會使染料產生聚集。染料聚集使清洗過程中無法洗凈,使得分析過程中仍存在未標記的細胞。
9. 將細胞在20-25℃條件下400×g離心10min,小心吸棄上清。用10mL完全培養基重懸,將重懸液轉移至另一新的無菌離 心管中,20-25℃條件下400×g離心5 min。用10mL完全培養基再清洗兩遍以除去沒 結合的染料。
注意1:將重懸液轉移至新離心管中,減少了離心管壁殘留的染料對洗滌效率的影響;
注意2:不要用稀釋液C清洗。
10. 最后一步清洗后,用10mL完全培養基重懸細胞評估細胞回收率,細胞活率和熒 光強度(圖2。離心重懸細胞至所需活細 胞濃度。
注意1:染色后的細胞可以用中性甲醛固定,避光條件下,熒光強度至少3周內保持穩定。
注意2:染色熒光強度一般為背景的100-1000倍。雖然染色的CV值與細胞種類有關,但熒光分布應該盡量均勻對稱。
圖2. PKH26染色優化
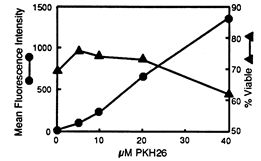
MC-38 TIL細胞用上述指定PKH26濃度染色,最終細胞濃度為1×107/ml。活力(▲)由FITC染色測定,平均熒光強度(●)用流式細胞儀檢測。用20μM PKH26標記后,抗腫瘤TIL特異性和效能沒有改變。




